資訊中心
在藥物化學領域,三氘代甲基的精確安裝正受到越來越多的關注。氘代“神奇甲基”的位點選擇性結合可以提供深遠的藥理學益處,并且可以被認為是藥物優化和開發的重要工具。
由于約 80% 的最暢銷藥物含有甲基,位點選擇性甲基化在藥物化學中的重要性怎么估計都不為過。1這并不奇怪,因為甲基化是生物學中最普遍和最重要的化學轉化之一。例如,僅一個 Me 單元即可區分胸腺嘧啶 (DNA) 和尿嘧啶 (RNA)。五個氨基酸只是甲基單位的數量和位置不同,這最終會影響酶的功能。同樣,甲基單元的安裝可以成為通過誘導立體電子效應和溶解度效應來深刻改變和優化藥物藥理特性的重要工具。通過立體電子效應,甲基化可以改變或提高化合物與受體的親和力,同時分子物理性質的變化最小。因此,甲基化可以成為開發更具選擇性和更有效藥物的策略。這種效應在藥物-生物受體相互作用的變化和改善方面可能是巨大的。例如,甲基化已被證明可以將拮抗劑轉變為激動劑/變構調節劑。據報道,在藥物與生物受體相互作用得到改善的情況下,藥效提高了 507 倍。?CH 到 C-Me 轉化產生的這種非常大的效力增加被描述為“神奇的甲基效應”。這種所謂的“神奇甲基效應”歸因于“誘導深刻的構象變化,導致低能構象異構體更好地接近束縛態”。此外,酶代謝的難易程度以及藥物的半衰期可能會受到立體電子學甲基化的影響。除了這些立體電子效應之外,由于支化,甲基化時溶解度也會發生變化,這反過來又可以提高目標位置的藥物利用率。與流行且空間類似的CF?3基團不同,該分子的親脂性在甲基化時不會發生太大變化,避免形成過于油膩的分子,從而違反Lipinsky規則。
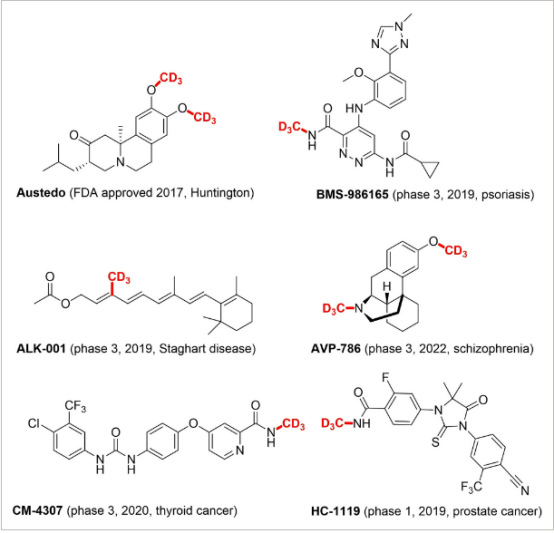
Lovering 的工作讓我們更深入地了解甲基化對生物活性化合物藥理學的影響。此處,飽和度的增加以及由此產生的化合物三維度(“逃離平地”)被描述為可帶來更高的臨床成功率。同時,飽和度的增加提高了溶解度。不僅在藥物開發中,而且在肽化學中,甲基化都被用作實現所需藥理學特性的成熟策略。當甲基的氫原子與氘原子互換(最傳統的等排取代)時,可以獲得藥用特性方面的額外益處。由于動力學同位素效應,CD-D 鍵比 C-H 鍵更強,因此用 CD-D 鍵替換 C-H 鍵可以使藥物不易氧化代謝,因此作用更長。除了優化藥代動力學外,位點選擇性氘化還可以通過“代謝分流”降低毒性、增加生物活性、穩定不穩定的立體異構體,甚至減少藥物相互作用。直到最近,人們對氘代藥物的興趣才有所增加,這主要是由于額外的成本和合成挑戰。2017年,氘代苯那嗪(Austedo)被FDA批準為第一個氘化藥物(圖?1)。事實上,氘苯那嗪只是通過所謂的“氘轉換”對市場上已有的藥物進行了改進。另一種策略是在藥物開發的早期階段摻入氘。
通過安裝三氘代甲基 (CD?3?) 基團,可以在一種化學結構單元中利用位點選擇性甲基化和氘化的上述優點。目前有多種含CD?3藥物處于臨床階段,第一個獲批的氘代藥物氘代丁苯那嗪包含兩個OCD?3組(圖?1)。